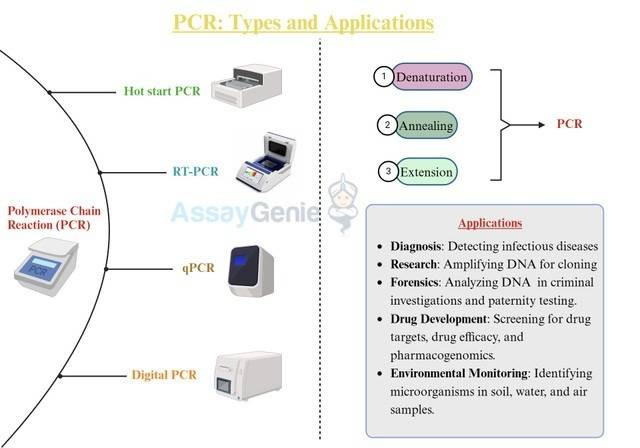
PCR : 種類と用途
重要なポイント
PCR は DNA 増幅の極めて重要な技術であり、研究、診断、法医学において重要です。
PCR
ポリメラーゼ連鎖反応 (PCR) は、DNA の特定のセグメントを増幅し、単一の DNA から数百万のコピーを作成するために使用される強力な実験技術です。 1980 年代に開発された PCR は、生物学研究、診断、法医学などのさまざまな分野で不可欠なツールとなっています。これにより、科学者は限られたサンプルや劣化したサンプルからでも、分析に十分な量の DNA を作成できるようになり、DNA 分析に革命をもたらしました。

ホットスタート PCR
ホットスタート PCR は、DNA 増幅の特異性と効率を高めるために設計された、従来のポリメラーゼ連鎖反応 (PCR) 技術の改良版です。これは、反応セットアップの初期段階での DNA ポリメラーゼ酵素の早期活性化により非特異的増幅が発生する可能性があるという、標準的な PCR における一般的な問題に対処します。これにより、望ましくない生成物が生成され、全体的な特異性が低下する可能性があります。ホットスタート PCR では、PCR プロセスの初期セットアップや最初の加熱ステップなど、低温で DNA ポリメラーゼが活性化するのを防ぐための対策が講じられます。目的は、非特異的産物の増幅を防止し、目的の標的配列の増幅を強化することです。これは、複雑な DNA テンプレートを扱う場合、または微量のターゲット DNA を含むサンプルを扱う場合に特に役立ちます。ホットスタート PCR の利点には、特異性の向上、感度の向上、最適化の軽減などがあります。
高忠実度ポリメラーゼ
DNA ポリメラーゼが元のテンプレート配列に非常に正確に増幅する場合でも、ヌクレオチド マッチング エラーが発生する可能性があります。クローニングなどのアプリケーションでは、ミスマッチにより転写産物が短くなり、タンパク質が誤って翻訳されたり、不活性になったりする可能性があります。 「校正」活性を持つポリメラーゼが発見され、これらの不一致を防ぐためにワークフローに組み込まれました。 Pyrococcus furiosus では、最初の校正ポリメラーゼである Pfu が 1991 年に発見されました。この Pfu 酵素の 3' から 5' エキソヌクレアーゼ活性。エキソヌクレアーゼは、DNA が増幅されるときに鎖の 3' 末端にあるミスマッチのヌクレオチドを除去します。その後、適切なヌクレオチドが置換され、DNA 合成が続行されます。
RT-PCR
一般に RT-PCR として知られる逆転写ポリメラーゼ連鎖反応は、逆転写とポリメラーゼ連鎖反応の原理を組み合わせた強力な分子生物学技術です。このメソッドは、RNA 分子を分析および増幅し、さらなる分析のためにそれらを相補 DNA (cDNA) に変換するように特別に設計されています。
qPCR および RT-qPCR
多くのアプリケーションでは、核酸は定量的 PCR (qPCR) を使用して検出、記述、定量化されます。 RT-qPCR では、前述のように、最初に cDNA に逆転写することによって RNA 転写物が定量化され、その後 qPCR が実行されることがよくあります。従来の PCR と同様に、変性、アニーリング、伸長という 3 つのプロセスが繰り返されて DNA が増幅されます。しかし、qPCR では、蛍光標識により PCR の進行に応じてデータを収集することが可能になります。さまざまな技術や化学反応が利用できるため、この技術にはいくつかの利点があります。

等温増幅
上述の PCR 法で変性、アニーリング、伸長段階のチャンバー温度を正確に増減するには、高価なサーモサイクリング装置が必要です。このような精密な装置を必要とせず、標的細胞内や単純なウォーターバス内でも使用できる方法が数多く考案されています。これらの方法は総称して等温増幅と呼ばれ、指数関数的、線形、またはカスケード増幅の原理に基づいて動作します。
デジタル PCR
デジタル ポリメラーゼ チェーン リアクション (デジタル PCR) は、従来の PCR の原理を新たなレベルの精度と感度に引き上げた最先端の分子生物学技術です。デジタル PCR は、サンプル中に存在する DNA または RNA 分子を、たとえそれらが非常に低濃度で存在する場合でも正確に定量し、分析するために使用されます。
Recent Posts
-
インフラマソーム活性化経路: 包括的な概要
インフラマソームは複雑な細胞内構造であり、病原性微生物や無菌ストレッサーを検出することで免疫応答において極めて重要な役割を果たします。それらの活性化は宿主防御システムの重要 …31st Dec 2024 -
遠心分離における RPM から G 力への変換
遠心分離機は科学研究やさまざまな産業において極めて重要な役割を果たし、サンプル内の成分の効率的な分離と単離を可能にします。遠心分離機の設定を最適化し、望ましい結果を達成する …31st Dec 2024 -
細胞内フローサイトメトリーの複雑さを乗り越える: 重要な考慮事項
進化する細胞生物学の状況において、細胞内フローサイトメトリー (ICFC) は、細胞内の複雑さを分析するための強力な技術として際立っています。この高度な方法は、研究者が個々 …31st Dec 2024