抗原提示細胞(APC)と癌免疫療法
重要なポイント
抗原提示とは?
MHC クラス I 抗原提示のプロセスは、病原体に対する強力な免疫応答を誘発するために不可欠です。分解されたペプチドは、MHC-I 分子に結合した後、細胞の小胞体 (ER) 内で入念な品質管理チェックを受けます。これにより、適切に形成されたペプチド-MHC 複合体のみが細胞表面に輸送され、表示されます。この厳格な選択プロセスにより、ウイルス抗原や腫瘍抗原によって生成されたペプチドなど、細胞内タンパク質に由来するペプチドのみが免疫系に提示されます。多様なペプチドのレパートリーを提示することにより、APC は、感染細胞や癌細胞を殺す役割を担う T 細胞の一種である細胞傷害性 T 細胞を刺激する上で重要な役割を果たします。細胞傷害性 T 細胞は、感染細胞や癌細胞を認識して排除する活性化マーカー CD8 の発現によって区別されます。 APC による抗原提示のこのプロセスは、自然免疫応答と獲得免疫応答の間の重要な橋渡しとして機能し、最終的には病原体や癌細胞に対する身体の防御力を強化します。
抗原提示細胞とは何ですか?
MHC-I 分子

ペプチド生成
MHC-I のローディングと輸送
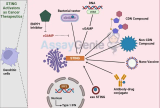
抗原提示とがん(免疫療法)
腫瘍新抗原
結論として、抗原提示細胞 (APC) は、腫瘍抗原を免疫系に提示し、がん細胞に対する標的免疫応答を開始することで、がん免疫療法において重要な役割を果たします。MHC クラス I 抗原提示経路を通じて、APC は細胞内タンパク質から派生した分解ペプチドを細胞表面に提示し、免疫系ががん細胞を認識して排除できるようにします。腫瘍新抗原の特定とペプチド選択ルールの理解は、個別化がん免疫療法に大きな可能性を秘めた進行中の研究分野です。APC の力を活用し、関連する複雑なメカニズムに関する知識を深めることで、より効果的でカスタマイズされた免疫療法アプローチの開発に努め、患者の免疫系を強化して、がんと闘う潜在能力を解き放つことができます。APC とがん免疫療法は、この複雑な疾患と闘うための新しい手段を提供し続ける、急速に進歩している分野です。
参考文献
Banchereau, J. & Palucka, a. K. (2005)、「がん治療ワクチンとしての樹状細胞」、Nature reviews。Immunology 5(4)、296–306。
Recent Posts
-
がんの共通特性 | Assay Genie
シェーン・ヒューストン、クイーンズ大学ベルファスト校博士候補がんは人類にとって古くからの敵です。異常細胞の制御不能な増殖は、歴史を通じて人間の健康に影を落としてきました。が …11th Mar 2025 -
がん治療薬としてのSTING活性剤
STING (インターフェロン遺伝子刺激因子) 経路は、がん細胞や DNA ウイルスに対する自然免疫システムの反応において極めて重要な役割を果たします。STING 活性剤を …8th Mar 2025 -
Nod 様受容体シグナル伝達経路: 自然免疫の要
病原体に対する主な防御線である自然免疫システムは、さまざまな細胞および分子メカニズムで構成されています。これらのうち、Nod 様受容体 (NLR) シグナル伝達経路は重要な …8th Mar 2025