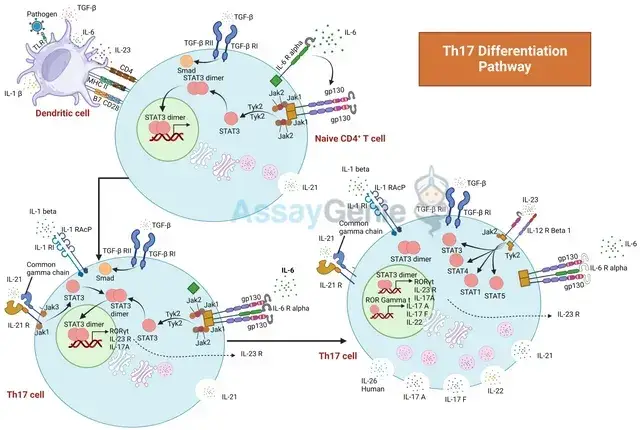
Th17 細胞の分化: 免疫学的ダイナミクスに関する洞察
Th17 分化の開始: サイトカインの前兆
TGF-β と IL-6 の役割
Th17 分化は、特定のサイトカイン、特に形質転換成長因子ベータ (TGF-β) とインターロイキン-6 (IL-6) の調整から始まります。TGF-β は、IL-6 などの他のサイトカインの存在に応じて、制御性 T 細胞 (Treg) または Th17 細胞系統へのコミットメントにつながる分岐経路の舞台を設定します。IL-6 は、IL-21 と連携して STAT3 を活性化し、RORγt 発現を増強することで、Th17 系統への分化プロセスを推進します。
IL-21 と IL-23 の影響
Th17分化の転写制御

マスターレギュレーター RORγt
脇役: STAT3、IRF4、BATF
IL-6 と IL-21 による STAT3 の活性化は、RORγt 誘導に不可欠です。IRF4 と BATF は、RORγt の発現を微調整し、IL-17 と関連サイトカインの転写を促進することで、Th17 分化をさらに調整します。これらの因子は協調して働き、Th17 表現型を強化します。
サイトカイン環境と Th17 の安定性
Th17 の拡大における IL-23 の役割
分化後、IL-23 は Th17 細胞の増殖とエフェクター機能を促進し、免疫と炎症における役割に重要な役割を果たします。このサイトカインは、自己免疫疾患における Th17 細胞の病原性にとって極めて重要です。
阻害性サイトカインの影響
健康と病気における Th17 細胞
病原体に対する保護的役割
Th17 細胞は、特に粘膜表面での真菌および細菌感染に対する防御に不可欠です。好中球を動員し、バリアの完全性を高める能力は、病原体除去に不可欠です。
自己免疫疾患への寄与
逆に、Th17 細胞の調節不全と過剰な IL-17 産生は、乾癬、関節リウマチ、炎症性腸疾患などの自己免疫疾患の発症と関連しています。Th17 分化の調節を理解することで、これらの疾患の治療ターゲットが得られます。
結論: Th17 細胞の二面性
Th17 細胞の分化は高度に制御されたプロセスであり、防御免疫と自己免疫病態の発症の両方にとって重要です。Th17 細胞の生物学を支配するサイトカインと転写因子の複雑なネットワークは、免疫システムの制御メカニズムの複雑さを強調しています。研究が進むにつれて、Th17 の分化と機能の特定の側面をターゲットにすることで、自己免疫疾患の新たな治療法や病原体に対する宿主防御を強化する戦略が期待されます。
参考文献
Recent Posts
-
がんの共通特性 | Assay Genie
シェーン・ヒューストン、クイーンズ大学ベルファスト校博士候補がんは人類にとって古くからの敵です。異常細胞の制御不能な増殖は、歴史を通じて人間の健康に影を落としてきました。が …11th Mar 2025 -
がん治療薬としてのSTING活性剤
STING (インターフェロン遺伝子刺激因子) 経路は、がん細胞や DNA ウイルスに対する自然免疫システムの反応において極めて重要な役割を果たします。STING 活性剤を …8th Mar 2025 -
Nod 様受容体シグナル伝達経路: 自然免疫の要
病原体に対する主な防御線である自然免疫システムは、さまざまな細胞および分子メカニズムで構成されています。これらのうち、Nod 様受容体 (NLR) シグナル伝達経路は重要な …8th Mar 2025