HAART中のHIV持続のメカニズム
HIV ウイルス: HAART がない場合の複製サイクルと病因
ウイルスと宿主の膜間の最初の接触により、ウイルス内容物を宿主細胞の細胞質に送達するための重要な導管である融合孔の形成が促進されます。この細胞環境内で、ウイルスの RNA ゲノムは逆転写を受け、DNA に変換されます。このウイルス DNA は細胞核に移行し、そこで宿主ゲノムにシームレスに組み込まれます。この組み込みは、ウイルス酵素インテグラーゼによって促進され、宿主細胞内でのウイルス遺伝物質の長期持続を保証します。宿主細胞が活性化すると、ウイルス遺伝子が発現され、その後細胞質に移行します。この細胞質領域内では、ウイルスタンパク質が合成され、注意深く組み立てられ、最終的には未熟なウイルス粒子が生成されます。このプロセスが最高潮に達すると、出芽プロセスを通じてこれらの粒子が宿主細胞から放出されます。これらのウイルス粒子の成熟の中心となるのは、ウイルスのプロテアーゼ酵素です。これは、ウイルスのポリタンパク質をその機能成分に切断する上で極めて重要な役割を果たし、それによって未熟なビリオンを感染性の形態に変換します。この変化は、ウイルスがさらに浸潤して他の細胞に感染する能力に不可欠です。
HIV 感染の経過は 3 つの異なる段階にわたって展開され、それぞれの段階はウイルス複製と宿主免疫応答の両方の影響を受けるさまざまな動態によって特徴付けられます。第 1 段階である急性症状段階は、血漿ウイルス量の急増、CD4+ T 細胞数の急激な減少、ウイルス保有者の確立、および抗 HIV 特異的免疫応答の出現を特徴とします。その後、ウイルス量が減少し、CD4+ T 細胞数が部分的かつ一時的に回復し、長期にわたる無症候性の慢性期の開始を示します。この段階では、ウイルス産生と CD4+ T 細胞数の減少が緩やかなペースで起こります。 CD4+ T 細胞数が 1 マイクロリットルあたり 200 細胞という臨界閾値を下回ると、エイズの最終段階が始まります。感染の過程を通じて、血漿 HIV RNA、全組み込み型および未組み込み型 HIV DNA、単核末梢細胞 (PBMC) に存在する HIV RNA など、さまざまな形態の HIV が検出されます。

HAART中のHIV持続: 恐ろしい現実

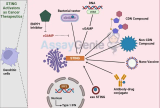
持続性のメカニズム
HAART レジメンの一環としてのインテグラーゼ阻害剤の導入は、HIV 複製と闘うための革新的なアプローチを提供します。これらの薬剤は感染後の HIV の組み込みを標的にし、ウイルスがその遺伝物質を宿主細胞の DNA に取り込むのを阻止します。興味深いことに、インテグラーゼ阻害剤を HAART に添加すると、末梢血中の細胞内に組み込まれていない HIV DNA が増加することが研究で示されています。この観察は、治療の全体的な有効性にもかかわらず、ウイルスの複製が繰り返されていることを間接的に示しています。興味深いことに、HIV 自体が細胞増殖の促進に関与していると考えられています。先駆的な研究により、HIV の組み込みと細胞増殖を調節する発がん遺伝子との関連が明らかになりました。この発見は、ウイルス感染と細胞機構との複雑な関係を強調し、ウイルスプールの維持に寄与する可能性がある。
免疫活性化と HIV 持続性: 敵か味方か?

今後の方向性
Recent Posts
-
がんの共通特性 | Assay Genie
シェーン・ヒューストン、クイーンズ大学ベルファスト校博士候補がんは人類にとって古くからの敵です。異常細胞の制御不能な増殖は、歴史を通じて人間の健康に影を落としてきました。が …11th Mar 2025 -
がん治療薬としてのSTING活性剤
STING (インターフェロン遺伝子刺激因子) 経路は、がん細胞や DNA ウイルスに対する自然免疫システムの反応において極めて重要な役割を果たします。STING 活性剤を …8th Mar 2025 -
Nod 様受容体シグナル伝達経路: 自然免疫の要
病原体に対する主な防御線である自然免疫システムは、さまざまな細胞および分子メカニズムで構成されています。これらのうち、Nod 様受容体 (NLR) シグナル伝達経路は重要な …8th Mar 2025